Por Tudo de Humanas
A tabela periódica foi desenvolvida por Dmitri Mendeleev em 1869, organizando os elementos químicos com base em suas propriedades e pesos atômicos. Essa organização permitiu prever a existência de elementos ainda não descobertos na época.
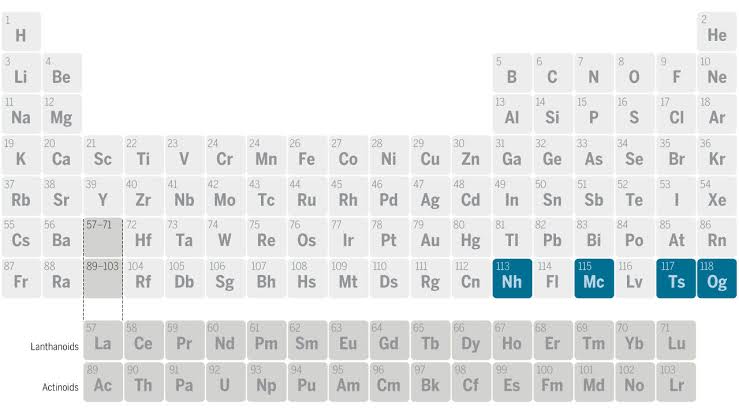
A tabela periódica é organizada com base nas propriedades dos elementos químicos. Eles são dispostos em ordem crescente de número atômico, que representa o número de prótons em um átomo. As colunas, chamadas de grupos, compartilham propriedades químicas semelhantes, enquanto as linhas, chamadas de períodos, indicam o aumento sequencial dos números quânticos. Os elementos são categorizados em metais, ametais e metaloides.
- H – Hidrogênio
- He – Hélio
- Li – Lítio
- Be – Berílio
- B – Boro
- C – Carbono
- N – Nitrogênio
- O – Oxigênio
- F – Flúor
- Ne – Néon
- Na – Sódio
- Mg – Magnésio
- Al – Alumínio
- Si – Silício
- P – Fósforo
- S – Enxofre
- Cl – Cloro
- Ar – Argônio
- K – Potássio
- Ca – Cálcio
- Sc – Escândio
- Ti – Titânio
- V – Vanádio
- Cr – Cromo
- Mn – Manganês
- Fe – Ferro
- Co – Cobalto
- Ni – Níquel
- Cu – Cobre
- Zn – Zinco
- Ga – Gálio
- Ge – Germânio
- As – Arsênio
- Se – Selênio
- Br – Bromo
- Kr – Criptônio
- Rb – Rubídio
- Sr – Estrôncio
- Y – Ítrio
- Zr – Zircônio
- Nb – Nióbio
- Mo – Molibdênio
- Tc – Tecnécio
- Ru – Rutênio
- Rh – Ródio
- Pd – Paládio
- Ag – Prata
- Cd – Cádmio
- In – Índio
- Sn – Estanho
- Sb – Antimônio
- Te – Telúrio
- I – Iodo
- Xe – Xenônio
- Cs – Césio
- Ba – Bário
- La – Lantânio
- Ce – Cério
- Pr – Praseodímio
- Nd – Neodímio
- Pm – Promécio
- Sm – Samário
- Eu – Európio
- Gd – Gadolínio
- Tb – Térbio
- Dy – Disprósio
- Ho – Hólmio
- Er – Érbio
- Tm – Túlio
- Yb – Itérbio
- Lu – Lutécio
- Hf – Háfnio
- Ta – Tântalo
- W – Tungstênio
- Re – Rênio
- Os – Ósmio
- Ir – Irídio
- Pt – Platina
- Au – Ouro
- Hg – Mercúrio
- Tl – Tálio
- Pb – Chumbo
- Bi – Bismuto
- Po – Polônio
- At – Astato
- Rn – Radônio
- Fr – Frâncio
- Ra – Rádio
- Ac – Actínio
- Th – Tório
- Pa – Protactínio
- U – Urânio
- Np – Neptúnio
- Pu – Plutônio
- Am – Amerício
- Cm – Cúrio
- Bk – Berquélio
- Cf – Californium
- Es – Einstênio
- Fm – Fermio
- Md – Mendelévio
- No – Nobélio
- Lr – Laurêncio
- Rf – Rutherfórdio
- Db – Dúbnio
- Sg – Seabórgio
- Bh – Bóhrio
- Hs – Hássio
- Mt – Meitnério
- Ds – Darmstádio
- Rg – Roentgênio
- Cn – Copernício
- Nh – Nihônio
- Fl – Fleróvio
- Mc – Moscóvio
- Lv – Livermório
- Ts – Tenessino
- Og – Óganeson
Os grupos na tabela periódica são as colunas verticais que compartilham características semelhantes entre os elementos. Aqui estão algumas explicações sobre alguns grupos principais:
Grupo 1 (Metais Alcalinos): Inclui elementos como o lítio (Li) e o sódio (Na). São metais altamente reativos e geralmente formam compostos iônicos.
Grupo 2 (Metais Alcalino-Terrosos): Inclui elementos como o magnésio (Mg) e o cálcio (Ca). Também são metais, mas são menos reativos que os do Grupo 1.
Grupo 17 (Halogênios): Inclui elementos como o flúor (F) e o cloro (Cl). São não-metais altamente reativos e tendem a formar compostos iônicos.
Grupo 18 (Gases Nobres): Inclui elementos como o hélio (He) e o néon (Ne). São gases inertes, geralmente não reativos, devido à completa ocupação de elétrons em suas camadas externas.
Blocos d e f: Os elementos nos blocos d e f formam os chamados “metais de transição” e “lantanídeos e actinídeos”, respectivamente. Os metais de transição são encontrados nos blocos d e têm propriedades variadas.
Esses são apenas alguns grupos, e existem padrões adicionais e subdivisões na tabela periódica. Cada grupo compartilha características específicas devido à sua configuração eletrônica, o que influencia seu comportamento químico.
Cada elemento químico na tabela periódica é composto por átomos do mesmo tipo. Um átomo, por sua vez, consiste em partículas subatômicas:
Prótons: Partículas com carga elétrica positiva, localizadas no núcleo do átomo.
Nêutrons: Partículas neutras, sem carga elétrica, também encontradas no núcleo do átomo.
Elétrons: Partículas com carga elétrica negativa, orbitam ao redor do núcleo em camadas chamadas de níveis de energia ou camadas eletrônicas.
O número de prótons em um átomo determina o elemento químico específico. Isso é chamado de número atômico. A massa do átomo é determinada pela soma de prótons e nêutrons no núcleo.
A notação padrão de um elemento químico inclui seu símbolo (como H para hidrogênio ou O para oxigênio), número atômico (número de prótons), e, geralmente, o número de massa (soma de prótons e nêutrons). Por exemplo, o átomo de hidrogênio tem um próton, e seu símbolo é H com um número atômico de 1.
O número total de elementos químicos no universo é desconhecido, mas na Terra, conhecemos e catalogamos 118 elementos até a última atualização do meu conhecimento em janeiro de 2022. Esses elementos vão desde o hidrogênio, o elemento mais leve, até o óganeson, o elemento mais pesado. A existência de elementos além do óganeson é teorizada, mas não foram sintetizados ou confirmados experimentalmente até a minha última atualização.
No universo observável, acredita-se que muitos elementos estejam presentes, especialmente aqueles formados por processos nucleossintéticos em estrelas, supernovas e outros eventos cósmicos. A diversidade química no cosmos é vasta, mas o número exato de elementos em todo o universo é uma questão em aberto.

